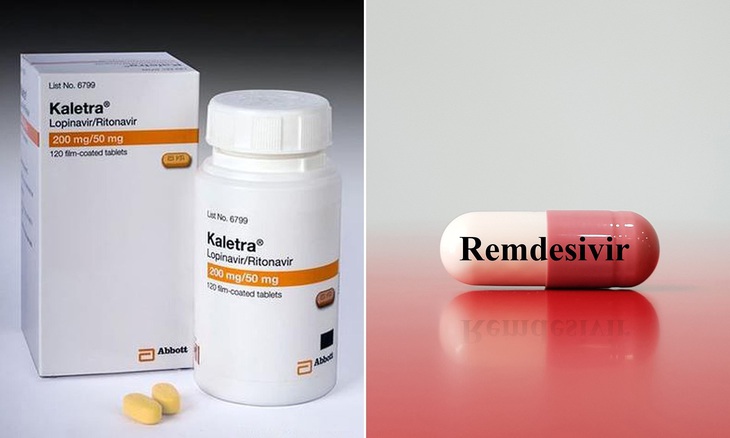
Thuốc lopinavir kết hợp ritonavir (điều trị nhiễm HIV) và remdesivir (điều trị nhiễm virus Ebola) được thử nghiệm điều trị COVID-19 - Ảnh: DAILY MAIL
Sử dụng kết hợp hydroxychloroquine và azithromycin dẫn đến nguy cơ gây nhiều phản ứng không mong muốn nghiêm trọng, đặc biệt về tim mạch.
Hiệp hội Dược lý và trị liệu Pháp
Để kết thúc cuộc tranh cãi về phương pháp dùng thuốc trị sốt rét hydroxychloroquine điều trị COVID-19 của GS Didier Raoult, ngày 31-3 bệnh viện trường đại học ở Angers (tỉnh Maine-et-Loire) thông báo đã hợp tác với 32 bệnh viện ở Pháp tiến hành cuộc thử nghiệm Hycovid.
Mục đích nhằm kiểm tra xem hydroxychloroquine có tác dụng điều trị COVID-19 hay không. Thử nghiệm được thực hiện đúng quy trình thử nghiệm lâm sàng (phương pháp mù đôi) trên 1.300 bệnh nhân tình nguyện trên 75 tuổi không cần máy trợ thở.
Thử nghiệm 4 phương pháp điều trị
Thật ra điểm tích cực trong nghiên cứu của GS Didier Raoult là làm sáng tỏ tiềm năng của thuốc hydroxychloroquine. Bởi thế hydroxychloroquine đã được chọn đưa vào danh sách các thuốc cần thử nghiệm lâm sàng vừa được châu Âu và Tổ chức Y tế thế giới (WHO) khởi động.
Ngày 22-3, châu Âu khởi động chương trình thử nghiệm lâm sàng thuốc điều trị COVID-19 mang tên Discovery. Thử nghiệm được thực hiện trên 3.200 bệnh nhân COVID-19 ở bảy quốc gia châu Âu (Pháp, Đức, Anh, Bỉ, Hà Lan, Tây Ban Nha và Luxembourg).
Tại Pháp, Viện Nghiên cứu sức khỏe và y học quốc gia Pháp (INSERM) phụ trách giám sát thử nghiệm trên 800 bệnh nhân đang nằm viện.
Thử nghiệm Discovery nhằm đánh giá hiệu quả và tính an toàn của bốn phương pháp điều trị gồm: thuốc remdesivir (thuốc kháng virus dùng để điều trị nhiễm virus Ebola, chưa lưu hành trên thị trường); kết hợp hai phân tử kháng virus HIV lopinavir và ritonavir; kết hợp lopinavir, ritonavir với beta interferon (thuốc điều trị viêm phổi); thuốc hydroxychloroquine (trị sốt rét).
Năm phân tử được chọn sau khi các nhà khoa học đã phân tích dữ liệu từ kinh nghiệm đối phó với hội chứng hô hấp cấp tính nặng (SARS) năm 2002/2003, hội chứng hô hấp Trung Đông (MERS-CoV) năm 2012/2013, nghiên cứu ban đầu về virus SARS-CoV-2 và các phương pháp điều trị ưu tiên hàng đầu theo quy định của WHO.
Tại Pháp, dự kiến 15 ngày sau khi thử nghiệm thuốc trên bệnh nhân, INSERM sẽ phân tích hiệu quả và tính an toàn của thuốc. Kết luận cuối cùng sẽ có sau 6-8 tuần.
Thử nghiệm Discovery được gọi là thử nghiệm mở vì các phương pháp điều trị được áp dụng ngẫu nhiên nhưng bệnh nhân và bác sĩ đều biết phương pháp nào được sử dụng.
Trước đó vào ngày 20-3, WHO bắt đầu chương trình thử nghiệm lâm sàng thuốc điều trị COVID-19 mang tên Solidarity. Một số nước như Pháp, Tây Ban Nha, Na Uy, Thụy Sĩ, Canada, Argentina, Iran, Bahrain, Nam Phi và Thái Lan đã đăng ký tham gia.
WHO thử nghiệm bốn phương pháp điều trị như châu Âu gồm remdesivir; kết hợp lopinavir với ritonavir; kết hợp lopinavir, ritonavir với beta interferon và hydroxychloroquine/chloroquine.
Quy trình thử nghiệm của WHO được tinh giản hơn bình thường. Bệnh nhân nhiễm COVID-19 sẽ được bác sĩ phụ trách điều trị giới thiệu tham gia thử nghiệm. Nếu đồng ý họ sẽ ký tên vào mẫu đơn. Bác sĩ sẽ chuyển đơn qua Internet cho WHO và thông báo loại thuốc thử nghiệm nào có sẵn tại bệnh viện.
WHO sẽ chỉ định ngẫu nhiên loại thuốc thử nghiệm nào. Quy trình này không đáp ứng yêu cầu nghiêm ngặt của phương pháp "mù đôi" (bệnh nhân và bác sĩ không biết loại thuốc nào được sử dụng) nhưng lại có ưu điểm cho kết quả nhanh chóng.
Nói chung trong bối cảnh khẩn trương đối phó dịch như thời chiến hiện nay, thay vì nghiên cứu thuốc điều trị mới, giới nghiên cứu dùng lại các loại thuốc đã được phê duyệt điều trị cho các bệnh khác như sốt rét, HIV/AIDS, Ebola nhằm điều trị COVID-19.
Thuốc chữa bệnh cho bệnh nhân phải qua quy trình thử nghiệm lâm sàng nghiêm ngặt - Ảnh: sudouest.fr
Từ ống nghiệm đến hiệu thuốc
Đối với thuốc điều trị thông thường, INSERM đánh giá phải mất 15 năm để một phân tử có tiềm năng trị liệu trở thành thuốc trị bệnh. Đây là quá trình dài diễn ra theo quy trình nghiêm ngặt.
Đầu tiên là giai đoạn nghiên cứu tiền lâm sàng, tức nuôi cấy tế bào trong ống nghiệm và trên động vật. Các nhà nghiên cứu sẽ thu thập dữ liệu sơ bộ về hành vi của phân tử có tiềm năng trị liệu.
Phân tử phải được thử nghiệm trên ba loài, trong đó có một loài gặm nhấm. Dữ liệu liên quan đến dược lý, dược động học và độc tính. Giai đoạn này giúp ước tính liều lượng thuốc sử dụng cho người dựa trên liều không gây độc hại trên động vật nghiên cứu.
Sau đó đến giai đoạn thử nghiệm lâm sàng ở người nhằm đánh giá tính an toàn và hiệu quả của thuốc. Thử nghiệm lâm sàng được chia làm ba giai đoạn.
* Giai đoạn I được thực hiện trên khoảng 20 tình nguyện viên nhằm quan sát tiến triển của thuốc trong cơ thể về thời gian và độc tính. Các tình nguyện viên thường ở lại vài ngày tại trung tâm nghiên cứu để kiểm tra nhiều thông số về tim, hô hấp, máu...
* Giai đoạn II được thực hiện trên các bệnh nhân tình nguyện nhằm xác định liều hiệu quả tối thiểu và các tác dụng phụ của thuốc. Đầu tiên là xác định liều hiệu quả tối thiểu mà không có tác dụng phụ hoặc tác dụng phụ thấp nhất. Kế đến là thử nghiệm thuốc cho từ 100-300 bệnh nhân.
* Giai đoạn III nhằm đánh giá hiệu quả của thuốc với số lượng bệnh nhân nhiều hơn, từ vài trăm cho bệnh ung thư đến hàng ngàn bệnh nhân cho các bệnh phổ biến như tăng huyết áp. Bệnh nhân được chia thành hai nhóm để so sánh hiệu quả thuốc. Giai đoạn này có thể kéo dài nhiều năm.
Sau khi thuốc đạt chuẩn được bán ra thị trường, giai đoạn IV sẽ được tiến hành nhằm theo dõi quá trình sử dụng thuốc thời gian dài trong điều kiện thực tế để phát hiện các tác dụng phụ hiếm gặp, biến chứng muộn hoặc thậm chí sai lệch.
Phát triển thuốc mới phải được thực hiện trong khuôn khổ luật pháp theo phương châm lợi ích con người luôn cao hơn lợi ích khoa học và xã hội.
Tại Pháp, muốn thử nghiệm lâm sàng thuốc phải có phép của Ủy ban Bảo vệ con người (CPP) và Cơ quan quốc gia về an toàn thuốc và sản phẩm y tế (ANSM). Thử nghiệm phải do một bác sĩ có thẩm quyền và chuyên gia trong lĩnh vực nghiên cứu chỉ đạo.
Muốn bán thuốc ra thị trường, công ty phải nộp hồ sơ xin cấp phép lưu hành trên thị trường (AMM). Trong hồ sơ phải có dữ liệu nghiên cứu tiền lâm sàng và lâm sàng. Tối thiểu phải mất một năm mới có AMM.
Trong trường hợp đặc biệt, ANSM có thể cấp giấy phép sử dụng thuốc tạm thời trong khi chờ xét duyệt hồ sơ AMM. Trường hợp này chỉ liên quan đến thuốc điều trị bệnh nhân nặng và không còn phương pháp điều trị nào khác thay thế như thuốc trị sốt rét hydroxychloroquine.
* Tại Pháp, theo khuyến cáo của Hội đồng cấp cao về y tế công cộng, ngày 24-3 Bộ Y tế đã cho phép dùng thuốc trị sốt rét hydroxychloroquine điều trị COVID-19 cho bệnh nhân nặng đang nằm viện trong vòng giám sát chặt chẽ của bác sĩ chuyên khoa.
Đây là trường hợp đặc biệt được sử dụng thuốc ngoài thẩm quyền của AMM.
* Tại Mỹ ngày 29-3, Cục Quản lý thực phẩm và dược phẩm Mỹ (FDA) đã cho phép sử dụng hydroxychloroquine và chloroquine để điều trị bệnh nhân COVID-19. Trường hợp này chỉ được áp dụng cho bệnh nhân đang nằm viện và được bác sĩ điều trị kê toa và theo dõi.
Trên thế giới, nhiều thử nghiệm lâm sàng thuốc hydroxychloroquine đang được triển khai ở nhiều quốc gia như Hàn Quốc, Thái Lan, Anh.
Vấn nạn vi khuẩn kháng thuốc sẽ trở nên trầm trọng nếu đại dịch COVID-19 hoành hành không kiểm soát tại Ấn Độ, quốc gia có 1,3 tỉ dân và mạng lưới hơn 75.000 bệnh viện đã quá tải.
Kỳ tới: Hiểm họa kháng thuốc

















Tối đa: 1500 ký tự
Hiện chưa có bình luận nào, hãy là người đầu tiên bình luận