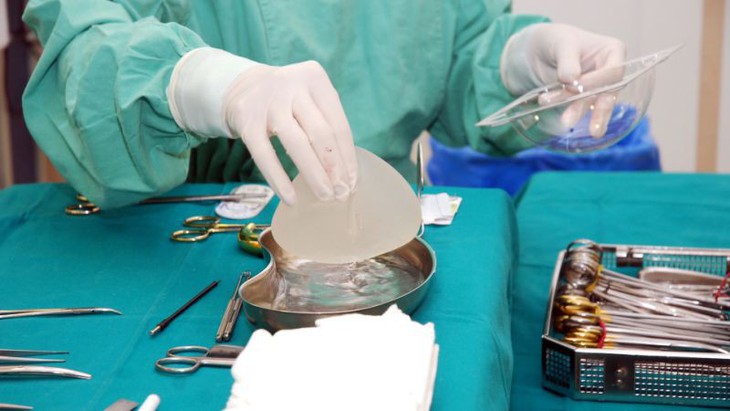
Chất lượng túi nâng ngực kém chất lượng đã gây ra cuộc khủng hoảng tại châu Âu vừa qua - Ảnh: AFP
Cuộc điều tra của ICIJ mang tên "Hồ sơ bộ phận cấy ghép" (Implant Files), công bố ngày 25-11-2018, kéo dài 10 tháng do 252 nhà báo thuộc 59 cơ quan báo chí ở 36 quốc gia tham gia thực hiện.
Túi lưới đựng cam thành... lưới nâng đường âm đạo
Cuộc điều tra quy mô của ICIJ bắt nguồn từ phát hiện của nữ nhà báo Jet Schouten làm việc cho Tập đoàn phát thanh-truyền hình AVROTROS ở Hà Lan.
Cách đây bốn năm, vào ngày 24-6-2014, Jet Schouten mua hai ký cam đựng trong túi lưới, sau đó cắt lấy túi lưới cho vào lòng bàn tay và chụp ảnh để đính kèm với bộ hồ sơ giả được cố tình soạn thảo đầy lỗi về sản xuất.
Bộ hồ sơ xin cấp phép lưu hành cho mẫu sợi polypropylene theo ảnh kèm là lưới nâng đường âm đạo dùng cho phụ nữ mắc chứng sa âm đạo.
Ba cơ quan kiểm định đã đồng ý về nguyên tắc sẽ cấp giấy chứng nhận CE (giấy của Cơ quan Chứng nhận châu Âu) cho lưới nâng âm đạo giả ấy bán ra thị trường châu Âu.
Nhà báo Jet Schouten rất ngạc nhiên với quy trình cấp phép quá sơ hở đến thế nên tìm đến ICIJ đề nghị tổ chức một cuộc điều tra quy mô về các bộ phận cấy ghép y tế như túi nâng ngực, máy tạo nhịp tim, khớp háng nhân tạo, khớp gối, khớp vai.

Nhà báo Hà Lan Jet Schouten, người phát hiện quy trình cấp phép cho bộ phận cấy ghép y tế quá dễ dãi - Ảnh: CJR. ORG
Cuộc điều tra lấy bí danh là Hippocrate (tên của ông tổ ngành y). 252 nhà báo đã nỗ lực thu thập dữ liệu và nhận dạng các bộ phận cấy ghép y tế đáng nghi ngờ.
Cuối cùng cuộc điều tra đã chứng minh quy trình kiểm định bộ phận cấy ghép y tế ở châu Âu rất lỏng lẻo.
Bằng chứng là ngày 29-11, tòa án Nanterre (Pháp) tuyên buộc Công ty TÜV của Đức (công ty kiểm định túi nâng ngực dỏm PIP) phải bồi thường tổng cộng 3 triệu euro cho 400 bệnh nhân nữ ở Thụy Điển.
Nỗi lo của các bộ trưởng chính là các thiết bị y tế. Các bộ trưởng đều biết quy định hiện hành chưa đủ mạnh"
Bộ trưởng Y tế Pháp Agnès Buzyn

Túi lưới đựng cam giả thành lưới nâng âm đạo vẫn được nhất trí cấp giấy chứng nhận CE - Ảnh: JET SCHOUTEN
Người bị kiểm định trả tiền cho người kiểm định
Kết quả điều tra của ICIJ ghi nhận có xung đột lợi ích trong quy trình kiểm định bộ phận cấy ghép y tế ở châu Âu.
Dược phẩm thường phải qua quá trình thử nghiệm lâm sàng trong thời gian dài và phải đáp ứng nhiều tiêu chuẩn nghiêm ngặt mới được đưa ra thị trường.
Trong khi đó đối với các bộ phận cấy ghép, các hãng sản xuất chỉ cần gửi hồ sơ đến tổ chức kiểm định đã chọn và trả chi phí để được cấp phép tương tự kiểm định ôtô hoặc máy giặt.
Hiện nay trên toàn châu Âu có 60 công ty kiểm định bộ phận cấy ghép y tế. Do đây là doanh nghiệp tư nhân nên vì mục đích thu lợi, họ chỉ xem xét qua hồ sơ.
Trong 96% trường hợp họ không kiểm tra thực tế sản phẩm. Do đó, các nhà sản xuất rất dễ đưa bộ phận cấy ghép y tế không đạt chất lượng ra thị trường.
Ví dụ để bán máy tạo nhịp tim ra các nước châu Âu, hãng sản xuất chỉ cần chứng minh hai điều: Máy hoạt động được và an toàn. Công ty kiểm định không đòi hỏi máy có mang lại hiệu quả hay không hay yêu cầu kết quả nghiên cứu lâm sàng nào cả.
Chính vì thế các sự cố về bộ phận cấy ghép y tế gia tăng. Tại Pháp, theo Cơ quan quốc gia về an toàn dược phẩm và sản phẩm y tế, số sự cố tăng gấp đôi trong 10 năm qua với hơn 18.000 ca năm 2017 và tổng cộng 158.000 ca trong 10 năm.
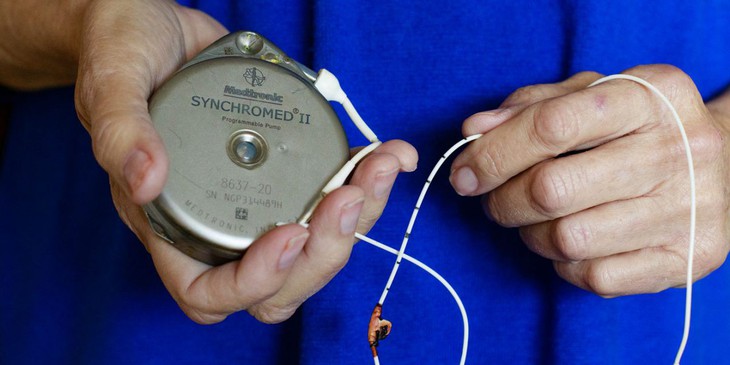
Bơm tiêm insulin của Công ty Mỹ Medtronic - Ảnh: ICIJ
Tại Mỹ, từ năm 2008-2017, sự cố do bộ phận cấy ghép y tế (túi nâng ngực, khớp háng nhân tạo, ống stent) đã gây ra 82.000 ca tử vong và 1,7 triệu ca bị thương.
Đứng đầu là bơm tiêm insulin cho người bị tiểu đường và các linh kiện do Công ty Mỹ Medtronic (đứng đầu thế giới về công nghệ y khoa) sản xuất với trên 2.600 ca tử vong và 150.000 ca bị thương.
Chúng tôi nhận thấy tai biến mạch máu não hai lần cao hơn nơi bệnh nhân nhận cấy ghép ống stent hơn các bệnh nhân sử dụng thuốc"
Giáo sư Eric Vicaut
Châu Âu dự tính đến cuối năm 2019 mới hoàn thành xong Cơ sở dữ liệu châu Âu về thiết bị y tế (Eudamed).
Đến tháng 5-2020, châu Âu mới áp dụng quy định mới về thành lập hội đồng chuyên gia châu Âu và yêu cầu điều tra trước khi cấp phép lưu hành cho các bộ phận cấy ghép y tế.
Song văn bản này chưa đủ vì nhưng như vậy châu Âu vẫn xem bộ phận cấy ghép y tế như hàng hóa chứ không phải sản phẩm y tế, tức ưu tiên cho lợi ích của nhà sản xuất hơn lợi ích bệnh nhân và quan tâm đến an toàn hơn hiệu quả mang lại.

















Tối đa: 1500 ký tự
Hiện chưa có bình luận nào, hãy là người đầu tiên bình luận