
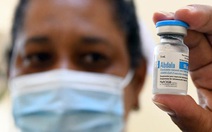
Các bệnh viện ở vùng Catalonia (Tây Ban Nha) đã bắt đầu chọn tình nguyện viên để tham gia cuộc thử nghiệm lâm sàng giai đoạn 1 với vắc xin của HIPRA hồi tháng 8-2021 - Ảnh: EFE
Ngày 11-9, trong khuôn khổ chuyến thăm Phần Lan, tại thủ đô Helsinki, Chủ tịch Quốc hội Vương Đình Huệ và các thành viên Đoàn đại biểu cấp cao Quốc hội Việt Nam đã dự lễ trao tặng vật tư, thiết bị y tế phòng, chống dịch COVID-19 và các biên bản thỏa thuận hợp tác kinh tế giữa các doanh nghiệp Việt Nam và châu Âu về chuyển giao công nghệ sản xuất và mua kit xét nghiệm COVID-19, hợp tác về thử nghiệm lâm sàng và mua bán vắc xin COVID-19.
Trong số các hoạt động, Công ty cổ phần dược phẩm T&T đã ký thỏa thuận hợp tác chuyển giao công nghệ và sản xuất các kit xét nghiệm RT-PCR Virella SARS-CoV-2 tại Việt Nam với Công ty GERBION GmbH & Co. KG (Đức), ký kết thỏa thuận hợp tác với Công ty HIPRA Human Health S.L. U (Tây Ban Nha) về thử nghiệm lâm sàng và mua vắc xin ngừa COVID-19 HIPRA SARS-CoV-2 với số lượng dự kiến 50 triệu liều, tổng giá trị hợp đồng khoảng 375 triệu euro (10.500 tỉ đồng).
Vậy vắc xin ngừa COVID-19 của HIPRA có gì đặc biệt?
Theo trang web HIPRA, vắc xin HIPRA SARS-CoV-2 là "vắc xin protein tái tổ hợp được thiết kế để tối ưu hóa tính an toàn và tạo ra phản ứng miễn dịch mạnh giúp vô hiệu hóa virus gây bệnh COVID-19".
HIPRA SARS-CoV-2 không cần bảo quản ở nhiệt độ quá thấp. Vắc xin này có thể được bảo quản ở nhiệt độ từ 2ºC đến 8ºC, giúp tạo điều kiện thuận lợi cho việc vận chuyển và phân phối.
HIPRA kỳ vọng các cuộc thử nghiệm lâm sàng với vắc xin này dự kiến hoàn tất thành công, để có thể bắt đầu sản xuất vào tháng 10-2021 và giao lô 75 triệu liều đầu tiên vào cuối năm nay.
HIPRA lên kế hoạch sản xuất 400 triệu liều vắc xin HIPRA SARS-CoV-2 trong năm 2022 và đạt 1,2 tỉ liều tính đến năm 2023.
HIPRA cho biết họ có 50 năm kinh nghiệm phát triển vắc xin. Công ty dược phẩm này sở hữu các nhà máy sản xuất ở Tây Ban Nha và Brazil.
Hôm 11-8, Cơ quan Dược phẩm và sản phẩm y tế Tây Ban Nha (AEMPS) đã cấp phép cho HIPRA bắt đầu các thử nghiệm lâm sàng trên người đối với vắc xin của họ. Đây là lần đầu tiên một loại vắc xin COVID-19 của Tây Ban Nha được phê duyệt thử nghiệm trên người.
Cũng trong tháng 8, các bệnh viện ở vùng Catalonia (Tây Ban Nha) đã bắt đầu chọn tình nguyện viên để tham gia cuộc thử nghiệm lâm sàng giai đoạn 1 với vắc xin này. Sau 21 ngày, các tình nguyện viên sẽ được tiêm liều 2.
Cuộc thử nghiệm lâm sàng giai đoạn 1 nhằm kiểm tra tính an toàn, khả năng dung nạp, tính sinh miễn dịch (khả năng tạo ra phản ứng miễn dịch) và hiệu quả của vắc xin trên.


















Tối đa: 1500 ký tự
Hiện chưa có bình luận nào, hãy là người đầu tiên bình luận