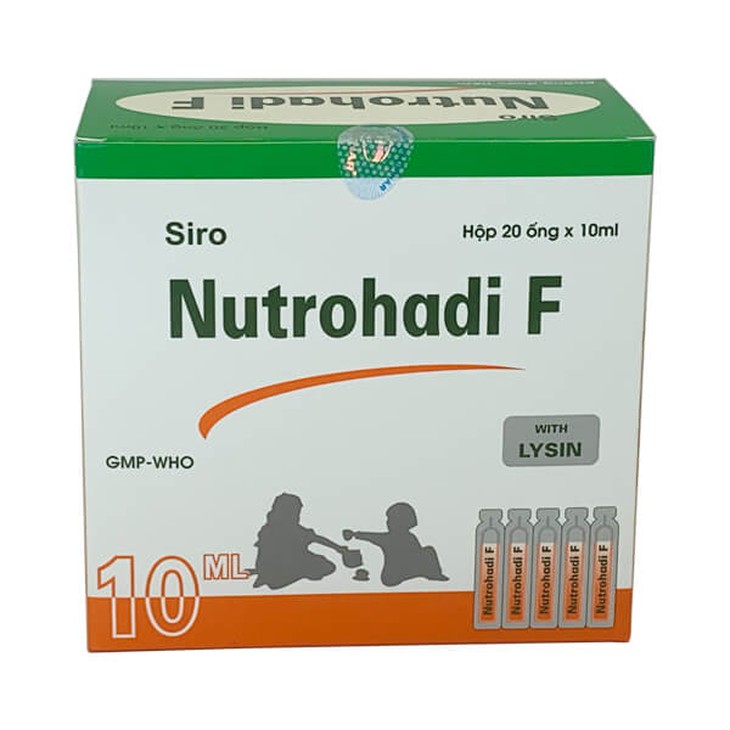
Mẫu thuốc Siro Nutrohadi F của Công ty cổ phần Dược Hà Tĩnh sản xuất - Ảnh: Web công ty
Cụ thể, tháng 11-2021, Cục Quản lý dược đã thông báo thu hồi 1 lô thuốc Siro Nutrohadi F của Công ty cổ phần Dược Hà Tĩnh sản xuất. Nguyên nhân do mẫu thuốc không đạt chất lượng về chỉ tiêu định lượng Riboflavin, Thiamin Hydoclorid, Tocopherol Acetat.
Sau đó, Cục Quản lý dược yêu cầu Công ty cổ phần Dược Hà Tĩnh phối hợp với cơ quan kiểm tra chất lượng, cơ quan kiểm nghiệm thuốc nhà nước lấy hai mẫu bổ sung và gửi mẫu để kiểm tra chất lượng đối với chỉ tiêu định lượng Riboflavin, Thiamin Hydoclorid, Tocopherol Acetat.
Mới đây, Cục Quản lý dược nhận được công văn của Công ty cổ phần Dược Hà Tĩnh gửi kèm phiếu kiểm nghiệm của Viện Kiểm nghiệm thuốc trung ương báo cáo kết quả lấy mẫu bổ sung đối với lô thuốc Siro Nutrohadi F, Số lô: 030221; NSX: 240221; HD: 230224 không đạt tiêu chuẩn chất lượng về chỉ tiêu định lượng Riboflavin, Thiamin Hydoclorid, Tocopherol Acetat, vi phạm mức độ 2.
Thuốc vi phạm mức độ 2 - là thuốc có bằng chứng không bảo đảm đầy đủ hiệu quả điều trị hoặc có nguy cơ không an toàn cho người sử dụng nhưng chưa đến mức gây tổn hại nghiêm trọng đối với sức khỏe hoặc chưa ảnh hưởng đến tính mạng của người sử dụng.
Căn cứ kết quả kiểm nghiệm, Cục Quản lý dược thông báo thu hồi toàn quốc thuốc Siro Nutrohadi F, Số GĐKLH: VD-18684- 13, Số lô: 030221; NSX: 240221; HD: 230224 do Công ty cổ phần Dược Hà Tĩnh sản xuất.
Cục Quản lý dược yêu cầu Công ty cổ phần Dược Hà Tĩnh phối hợp với nhà phân phối thuốc gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng lô sản phẩm trên. Đồng thời, công ty tiến hành thu hồi toàn bộ lô thuốc không đạt tiêu chuẩn chất lượng nêu trên và gửi báo cáo thu hồi về Cục Quản lý dược trong vòng 18 ngày.
Sở Y tế các tỉnh, thành phố trực thuộc trung ương, y tế các ngành thông báo cho các cơ sở kinh doanh, sử dụng thuốc thu hồi lô thuốc không đạt chất lượng nêu trên, công bố thông tin về quyết định thu hồi thuốc trên trang thông tin điện tử; xử lý những đơn vị vi phạm theo quy định hiện hành.


















Tối đa: 1500 ký tự
Hiện chưa có bình luận nào, hãy là người đầu tiên bình luận