
TS George Painter - Ảnh: med.emory.edu
Ước mơ dùng thuốc điều trị COVID-19 tại nhà có thể sẽ trở thành hiện thực một ngày không xa. Một trong những hy vọng lớn đang đặt vào thuốc "đột phá" molnupiravir, thuốc kháng virus dạng viên đầu tiên có tác dụng chống nhiều chủng biến thể.
Từ trị bệnh cúm chuyển sang trị COVID-19
Câu chuyện thuốc viên molnupiravir khởi đầu bên lề một cuộc hội thảo về chăm sóc sức khỏe do Ngân hàng J.P. Morgan tổ chức tại khách sạn Handsion Union Square ở San Francisco (Mỹ) hồi tháng 1-2020. TS George Painter - chủ tịch Viện Phát triển thuốc Emory và bà Wendy Holman - giám đốc điều hành Công ty công nghệ sinh học Ridgeback Biotherapeutics đã gặp nhau thảo luận về kế hoạch thử nghiệm molnupiravir.
Hoạt chất molnupiravir đã được Painter (chuyên gia hóa học nắm 45 bằng sáng chế) phát triển với nguồn tài trợ từ Viện Y tế quốc gia (NIH). Các nhà khoa học tin rằng molnupiravir có thể trở thành thuốc kháng virus phổ rộng.
Lúc bấy giờ Painter chỉ hy vọng molnupiravir được nhận tài trợ nhiều hơn để nghiên cứu thành thuốc điều trị bệnh cúm trong khi Holman háo hức muốn biết molnupiravir có tác dụng chống virus Ebola hay không. Không bên nào nhắc đến COVID-19 bởi vào thời điểm đó virus SARS-CoV-2 vẫn chưa hoành hành dữ dội.
Vài hôm sau, bà Wendy Holman đến Atlanta tham quan các phòng thí nghiệm của Viện Emory và xem xét các dữ liệu ban đầu, sau đó Công ty Ridgeback đồng ý mua molnupiravir và tiến hành thử nghiệm trên người. Hôm Ridgeback thông báo đã mua lại hoạt chất molnupiravir ngày 19-3-2020, thế giới đã hiểu rõ hiểm họa COVID-19.
Rõ ràng cần thử nghiệm molnupiravir ngay lập tức để phát triển thành thuốc điều trị COVID-19. Tháng 4-2020, thử nghiệm lâm sàng đối với molnupiravir bắt đầu. Một tháng sau, Công ty dược Merck & Co. đã ký hợp đồng mua lại hoạt chất molnupiravir từ Ridgeback và bắt đầu thử nghiệm lâm sàng trên quy mô lớn.
Khi virus xâm nhập tế bào, nó giải phóng ARN nhằm nhân bản chính nó rồi tiếp tục lây nhiễm các tế bào khác. Thuốc kháng virus molnupiravir có chức năng gây rối quá trình sao chép của virus bằng cách chèn lỗi vào ARN virus để virus không thể tạo ra các hạt virus lây nhiễm.
Tuy nhiên, cũng có những lo ngại tác động virus kiểu như vậy có thể dẫn đến hậu quả khó lường. Công ty Pharmasset ở New Jersey đã từng nghiên cứu thành phần chính của molnupiravir rồi cuối cùng bỏ cuộc vì lo ngại molnupiravir có thể gây đột biến gene dẫn đến dị tật bẩm sinh.
Nhiều năm trước, TS George Painter đã nghiên cứu cấu trúc hóa học của molnupiravir. Sau đó, nhận thấy Cơ quan Giảm thiểu đe dọa quốc phòng (Bộ Quốc phòng Mỹ) quan tâm nên ông nghiên cứu molnupiravir nhằm điều trị bệnh viêm não ngựa Venezuela và chống lại các loại virus corona gây hội chứng hô hấp cấp tính nặng (SARS) và hội chứng hô hấp Trung Đông (MERS). Cuối năm 2016, ông sửa đổi cấu trúc hóa học thành tiền chất có thể dùng dưới dạng thuốc viên.
Sau giai đoạn nghiên cứu ban đầu, Painter đã chọn bệnh cúm làm mục tiêu điều trị của molnupiravir. Thế nhưng Cơ quan Nghiên cứu và phát triển y sinh tiên tiến (Bộ Y tế Mỹ) lại không chịu tài trợ vì lo sợ molnupiravir gây dị tật bẩm sinh đồng thời muốn có thêm dữ liệu an toàn cho chắc ăn. Đây là thời điểm bà giám đốc Wendy Holman của Ridgeback Biotherapeutics nhập cuộc.
Bà Holman đã tận dụng mọi mối quan hệ với ý định xây dựng một cơ sở thử nghiệm tính an toàn của molnupiravir ở Anh. Bà nhớ lại: "Tôi đã làm mọi thứ. Không có người bạn nào tôi không gọi. Không có đồng nghiệp nào tôi không cầu xin".
Thế rồi, Ridgeback đã hợp tác với Công ty Merck để bảo đảm sản xuất số lượng lớn thuốc cho thế giới. Sau khi đạt được thỏa thuận mua lại molnupiravir từ Ridgeback, Merck đã khởi động các cuộc thử nghiệm giai đoạn II/ III, đồng thời tuyển gần 3.000 bệnh nhân ở Mỹ, Colombia, Israel, Nga và nhiều nơi khác tham gia.
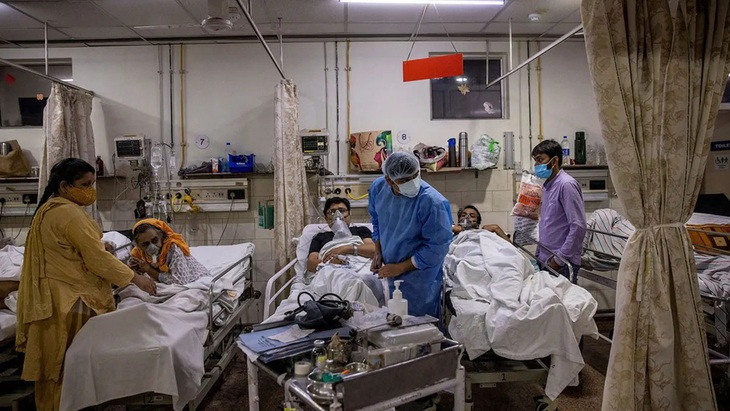
Ấn Độ cần thuốc điều trị hiệu quả để tránh quá tải bệnh viện - Ảnh: Reuters
Merck cam kết không giữ độc quyền
Đầu tháng 3-2021, kết quả một nghiên cứu nhỏ trên 202 người mắc COVID-19 không nhập viện được công bố. Tác giả chính của nghiên cứu là bác sĩ Wendy Painter - giám đốc y tế của Công ty Ridgeback và chính là bà xã của TS George Painter. Kết quả nghiên cứu cho thấy sau năm ngày uống molnupiravir, một số bệnh nhân đã có dấu hiệu giảm tải lượng virus. Đây là dấu hiệu tốt nhưng chưa toàn diện vì cỡ mẫu quá nhỏ.
Vấn đề mọi người quan tâm nhất là tính an toàn của molnupiravir. Theo tạp chí Bloomberg, tại một hội thảo về bệnh nhiễm trong tháng 3-2021 có đại diện của Ridgeback trình bày tham luận, một nhóm nghiên cứu từ Đại học Bắc Carolina đã thẳng thắn đề nghị nên hạn chế sử dụng molnupiravir vì về lâu dài molnupiravir có thể gây đột biến ADN.
Về vấn đề này, bác sĩ Nicholas Kartsonis - phó chủ tịch của Merck - giải thích Merck đã tiến hành thử nghiệm trong phòng thí nghiệm, trên động vật gặm nhấm và trên người với kết quả rất đáng tự tin. Đặc biệt trong hai thử nghiệm riêng rẽ xem xét khả năng molnupiravir thay đổi ADN trong cơ thể sống, thuốc được nghiên cứu với liều cao hơn và thời gian dài hơn so với liều sử dụng cho người. Kết quả cho thấy thuốc không hề gây đột biến gene.
Tại hội nghị châu Âu về vi sinh lâm sàng và bệnh truyền nhiễm (ECCMID) được tổ chức trực tuyến hôm 12-7, đại diện của Merck thông báo kết quả tạm thời từ hai thử nghiệm lâm sàng giai đoạn II của molnupiravir "rất hứa hẹn". Trước đó vào tháng 6-2021, Merck đã đạt được thỏa thuận cung cấp thuốc molnupiravir cho chính phủ.
Theo hợp đồng, nếu molnupiravir được cấp giấy phép sử dụng khẩn cấp (EUA) hoặc được Cơ quan Quản lý thực phẩm và dược phẩm (FDA) cấp phép lưu hành, Merck sẽ nhận được 1,2 tỉ USD để cung ứng 1,7 triệu liều molnupiravir cho Bộ Y tế và dịch vụ nhân sinh Mỹ.
Merck đang đầu tư mở rộng quy mô sản xuất molnupiravir với sản lượng dự kiến 100 triệu viên molnupiravir đủ để điều trị cho 10 triệu người vào cuối năm 2021. Merck còn kỳ vọng dùng molnupiravir như thuốc điều trị dự phòng được uống sau khi phơi nhiễm.
Đối với các cơ quan quản lý dược phẩm ngoài Mỹ, Merck đã có kế hoạch đăng ký sử dụng khẩn cấp thuốc molnupiravir hoặc đăng ký lưu hành molnupiravir. Merck đã cam kết sẽ ký thỏa thuận cấp phép tự nguyện không độc quyền đối với thuốc molnupiravir cho các nhà sản xuất thuốc generic để đưa thuốc đến 104 quốc gia có thu nhập thấp và trung bình.
Trong khuôn khổ cam kết này, vào cuối tháng 6-2021 năm "đại gia" dược phẩm ở Ấn Độ đã hợp tác với Merck thử nghiệm lâm sàng molnupiravir tại Ấn Độ. Các bên sẽ cùng tài trợ, giám sát và theo dõi quá trình thử nghiệm. Thử nghiệm bắt đầu từ tháng 6 kéo dài ba tháng với tối thiểu 1.200 người mắc COVID-19 dạng nhẹ đang điều trị ngoại trú tham gia.
Sau khi thử nghiệm thành công, mỗi công ty dược Ấn Độ sẽ tự xin giấy phép sản xuất molnupiravir. Đây là lần đầu tiên ngành công nghiệp dược phẩm Ấn Độ tham gia mô hình hợp tác thử nghiệm lâm sàng như thế.
Trong nhiều thế kỷ, hạt cây thì là đen (Nigella Sativa) nguồn gốc từ Bắc Phi và Tây Á đã được trị nhiều bệnh, nhất là các bệnh viêm nhiễm. Mới đây, ba nhà nghiên cứu ở Đại học Công nghệ Sydney (Úc) khẳng định cây thì là đen còn có thể điều trị COVID-19.
3 loại thuốc qua đường uống
Ngoài molnupiravir, Mỹ còn có hai dự án thuốc điều trị COVID-19 qua đường uống đầy triển vọng. Thuốc kháng virus AT-527 do Công ty dược phẩm Roche (Thụy Sĩ) hợp tác với Công ty sinh học dược Atea Pharmaceuticals (Mỹ) phát triển được dự kiến bán ra thị trường đầu năm 2022. AT-527 được dùng để điều trị trong bệnh viện và cơ sở ngoại trú.
PF-07321332 của Hãng dược phẩm Pfizer là thuốc ức chế protease nhắm vào các protease của virus để ngăn chúng nhân lên xâm nhập tế bào. Thuốc được dự kiến điều trị cho người mới mắc COVID-19 chưa cần nhập viện hoặc điều trị tích cực để ngăn bệnh tiến triển nặng thêm. Pfizer hy vọng bán thuốc ra thị trường vào cuối năm 2021.
Tại Nhật, Công ty dược phẩm Shionogi ở Osaka đã bắt đầu thử nghiệm lâm sàng giai đoạn I đối với thuốc kháng virus S- 217622 dùng qua đường uống. Thuốc dành cho người mắc COVID-19 dạng nhẹ và trung bình có triệu chứng. Shionogi dự kiến sẽ đề nghị cấp phép lưu hành vào cuối năm nay.
















Tối đa: 1500 ký tự
Hiện chưa có bình luận nào, hãy là người đầu tiên bình luận