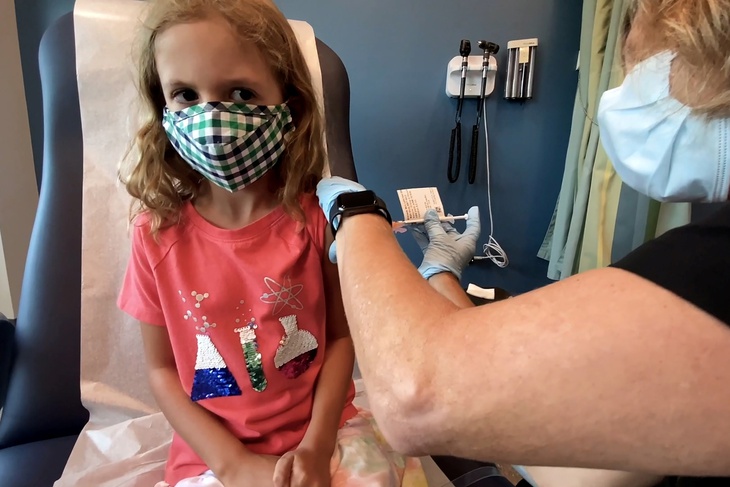
Em Lydia Melo, 7 tuổi, được tiêm liều 10 microgram vắc xin COVID-19 của Pfizer-BioNTech trong một thử nghiệm tại ĐH Duke ở Durham, bang North Carolina, Mỹ ngày 28-9-2021 - Ảnh: Reuters
Hiện vắc xin COVID-19 của Hãng Pfizer-BioNTech (Comirnaty) là vắc xin duy nhất ở Mỹ được Cơ quan Quản lý thực phẩm và dược phẩm (FDA) phê chuẩn đầy đủ. Tuy nhiên, trong nội dung phê chuẩn này, vắc xin Comirnaty chỉ được dùng cho người từ 16 tuổi trở lên. Với người từ 12-15 tuổi, vắc xin này vẫn chỉ được sử dụng khẩn cấp (Emergency Use Authorization, EUA), không được dùng cho người dưới 12 tuổi.
Tại sao việc sử dụng vắc xin trên người nhỏ tuổi, nhất là trẻ em phải thận trọng như vậy? Vì sao Pfizer-BioNTech phải chia ra các nhóm tuổi để làm thử nghiệm lâm sàng và xin phép sử dụng từng bước một như thế? Câu trả lời ngắn gọn nhất là vì "sự an toàn" và "trẻ em không phải là người lớn thu nhỏ".
An toàn là số 1
Tất cả các thuốc và vắc xin trước khi đến tay người dùng đại trà đều phải trải qua các giai đoạn nghiên cứu trong phòng thí nghiệm, thử nghiệm tiền lâm sàng (trên động vật) và thử nghiệm lâm sàng (trên người).
Các giai đoạn thử nghiệm trước phải chứng minh đạt đủ các tiêu chí đặt ra mới tiếp tục đi đến các thử nghiệm sau. Trong các tiêu chí đó, an toàn là tiêu chí quan trọng nhất.
Để đánh giá được tiêu chí này, các nghiên cứu phải đủ lớn (về số người tham gia, về sự cân bằng giới tính, về đa dạng chủng tộc, độ tuổi...); phải có nhóm đối chứng chặt chẽ (đặc điểm tương đồng với nhóm thử nghiệm, sống trong cùng điều kiện) và số liệu so sánh phải có ý nghĩa xác suất thống kê.
Trong các thử nghiệm thì thử nghiệm lâm sàng là rất quan trọng vì trực tiếp thử trên người. Dù trước đó các thử nghiệm trong phòng thí nghiệm hay trên động vật có những kết quả rất khả quan và an toàn, nhưng cơ thể người vẫn có nhiều đặc điểm sinh học rất khác biệt, khả năng gặp các phản ứng phụ chưa ghi nhận trong các thử nghiệm trước vẫn có thể xảy ra.
Do vậy, để đảm bảo an toàn, thử nghiệm lâm sàng được chia ra làm 4 pha (phase) với số người tăng lên ở từng pha để đảm bảo an toàn tối đa trong việc đánh giá hiệu quả vắc xin.
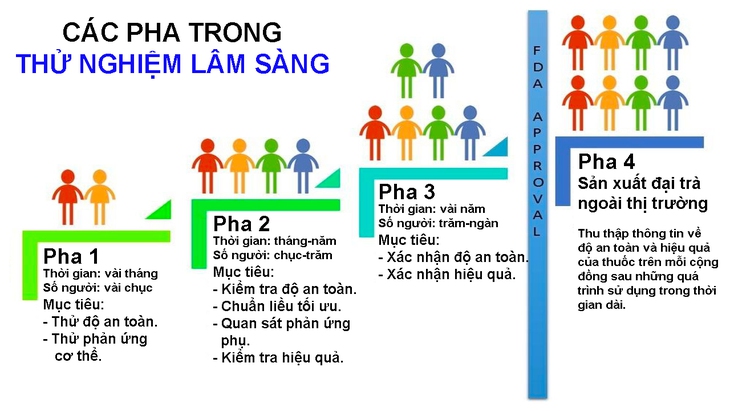
Đồ họa: N.H.V.
Bao giờ đến trẻ em?
Trong lần thử nghiệm lâm sàng đầu tiên, người ta chỉ tuyển những tình nguyện viên là người trưởng thành, khỏe mạnh, không có bệnh nền vì cơ thể họ khá ổn định về sinh học và có sức chịu đựng tốt hơn, nếu xảy ra biến chứng thì rủi ro sẽ thấp hơn.
Chỉ khi tất cả các thử nghiệm trên người trưởng thành đều cho kết quả an toàn và hiệu quả đến pha 3, người ta mới mở rộng thử nghiệm lên những nhóm "nhạy cảm" hơn, trong đó có nhóm người chưa trưởng thành và trẻ nhỏ.
Đối với trẻ nhỏ, vì hệ miễn dịch của trẻ nhạy cảm hơn và cân nặng của chúng nhẹ hơn nên cũng phải cẩn trọng hơn về liều lượng vắc xin và các phản ứng phụ tiềm ẩn.
Trong trường hợp vắc xin COVID-19 của Hãng Pfizer-BioNTech, họ đã thử nghiệm lần đầu tiên với người từ 16 tuổi trở lên với tổng số tình nguyện viên khoảng 44.000 người ở cả 3 pha 1, 2, 3.
Sau khi FDA xem xét các kết quả này và đánh giá vắc xin Comirnaty đạt được tiêu chí an toàn và hiệu quả, họ đã cấp phép sử dụng khẩn cấp vào ngày 11-12-2020.
Sau đó, công ty đã mở rộng thử nghiệm lâm sàng với trẻ trong độ tuổi từ 12-15 trên 2.260 người tham gia. Đến ngày 10-5 năm nay, dựa trên kết quả nghiên cứu cho thấy vắc xin vẫn an toàn và hiệu quả như mong đợi với hầu hết là những phản ứng phụ nhẹ, không nguy hiểm, FDA đã đồng ý nới rộng độ tuổi cho phép sử dụng vắc xin này từ 12 tuổi trở lên.
Tiếp theo đó, công ty lại thực hiện những nghiên cứu vắc xin cho trẻ từ 5-11 tuổi. Ngày 20-9 họ đã công bố một số kết quả bước đầu khá khả quan với kết quả an toàn và đáp ứng miễn dịch tốt với lượng kháng thể trung hòa cao tương đương người lớn.
Họ đã sử dụng liều vắc xin thấp hơn 1/3 so với người lớn (chỉ dùng 10 microgram thay vì 30 microgram cho mỗi liều), thời gian giữa 2 liều được giữ nguyên là 21 ngày.
FDA vẫn đang xem xét để cân nhắc việc có thể cấp phép sử dụng vắc xin cho độ tuổi này hay không. Ngoài ra, hãng dược cũng đang có kế hoạch tiếp tục nới rộng nghiên cứu ở trẻ từ 2-5 tuổi và từ 6 tháng đến 2 tuổi.
Qua đây chúng ta thấy việc nghiên cứu vắc xin trên trẻ cần được thực hiện thận trọng và từng bước với độ tuổi giảm dần và liều vắc xin cũng phải được cân nhắc cho phù hợp.
Cần ưu tiên nhóm nguy cơ cao
Đối với bệnh COVID-19, chúng ta còn được biết hầu hết trẻ em khi mắc sẽ bị nhẹ, nhanh khỏi và phần lớn không có triệu chứng, chỉ một tỉ lệ rất rất nhỏ bị trở nặng hoặc tử vong.
Đây là một hiện tượng đang được các nhà khoa học nghiên cứu và làm rõ. Do vậy, việc sử dụng vắc xin COVID-19 cho trẻ nhỏ chủ yếu là để giảm tối đa tỉ lệ trẻ bị biến chứng khi mắc bệnh và để chúng không trở thành nguồn lây trung gian cho những người khác trong cộng đồng, nhất là những người có nguy cơ cao như ông bà, cha mẹ lớn tuổi chưa chích vắc xin.
Do vậy, ở các nước chưa có đủ vắc xin cho những nhóm người có nguy cơ cao khi mắc bệnh như nhóm người lớn tuổi, có bệnh nền... thì vẫn nên ưu tiên vắc xin cho họ trước.
Do đặc tính sinh học của trẻ em có nhiều điểm khác với người lớn, việc sử dụng vắc xin cho chúng nên được "cẩn trọng", chỉ nên dùng các vắc xin đã có nghiên cứu cụ thể và sử dụng đúng liều lượng phù hợp cho từng lứa tuổi.

Tiến độ triển khai thử nghiệm lâm sàng theo độ tuổi của vắc xin COVID-19 do Pfizer-BioNTech phát triển - Đồ họa: N.KH
Hướng dẫn tiêm vắc xin cho trẻ trong tháng 10
Trao đổi với Tuổi Trẻ, Thứ trưởng Bộ Y tế Đỗ Xuân Tuyên cho biết bộ đã giao cơ quan chức năng xây dựng hướng dẫn tiêm chủng vắc xin ngừa COVID-19 cho trẻ 12-17 tuổi, dự kiến ban hành trong tháng 10 này để kịp triển khai.
Theo thông tin từ Cổng thông tin tiêm chủng COVID-19 quốc gia, tính đến trưa 9-10, cả nước đã tiêm được gần 52,55 triệu mũi cho người từ 18 tuổi trở lên, đã có 6 tỉnh thành tiêm được mũi 1 cho hơn 90% dân số, 3 tỉnh thành tiêm được mũi 1 cho 80-90% dân số, tỉ lệ tiêm đủ 2 mũi ở nhiều tỉnh thành đạt 30%. Tốc độ tiêm chủng đang tăng rất nhanh từ cuối tháng 7 đến nay và các ngày đầu tháng 10, mỗi ngày đều tiêm trên 1 triệu mũi.
Học sinh các cấp học phổ thông (dưới 18 tuổi) chưa có chỉ định tiêm vắc xin COVID-19 và vắc xin cho nhóm này cũng chưa về.
Tuy nhiên, nguồn tin của Tuổi Trẻ cho biết, dự kiến từ nay đến cuối năm sẽ có khoảng 48 triệu liều Pfizer về Việt Nam, tập trung trong tháng 11 và 12, trong đó có hơn 20 triệu liều Pfizer theo hợp đồng với nhà sản xuất là mua cho nhóm vị thành niên 12-17 tuổi.
Việt Nam có hơn 9 triệu trẻ trong độ tuổi này và trên 20 triệu liều Pfizer sẽ đủ tiêm cho nhóm đó khi có chỉ định tiêm chủng. Bộ trưởng Bộ Y tế Nguyễn Thanh Long cho biết sang năm 2022, Việt Nam sẽ mua vắc xin ngừa COVID-19 cho trẻ 5-11 tuổi.
Nếu vắc xin về đúng theo kế hoạch, Việt Nam có thể tiêm cho trẻ từ tháng 11 và kịp cho các em đến trường từ thời điểm đầu tháng 11, tức giữa học kỳ 1 năm nay.
LAN ANH














Tối đa: 1500 ký tự
Hiện chưa có bình luận nào, hãy là người đầu tiên bình luận